植物遺伝子機能研究室では、植物の器官分化や成長について、分子レベルでの仕組みを解明しています。特に注力している研究が「茎の伸長」に関する研究です。
茎の伸長に関する分子メカニズムの解明
茎の役割と農業への重要性
植物は、葉、花、茎、根という4つの主要な器官から構成されています。その中でも茎は、葉や花を支えるだけでなく、茎の中にある維管束を使って、根から吸収した水やミネラルを運搬する機能や、葉で行われる光合成によって生産された糖を輸送する役割を担っています。農業において、茎の長さや太さは、作物が倒れにくいかどうか(倒伏耐性)に関わる重要な要素です。化学肥料の普及により収量の増加が可能になった一方で、茎が過剰に伸びて倒れやすくなる問題も起きました。そのため、倒れにくい品種を作るために、茎を短くする遺伝子を使ったイネやコムギの品種改良が進められました。例えば、sd1(semi dwarf1)遺伝子を使った半矮性イネや、Rht-B1b(Reduced height)遺伝子を使った半矮性コムギ品種が育成され、世界中に普及しています(図1)。
茎の構造と伸長の仕組み
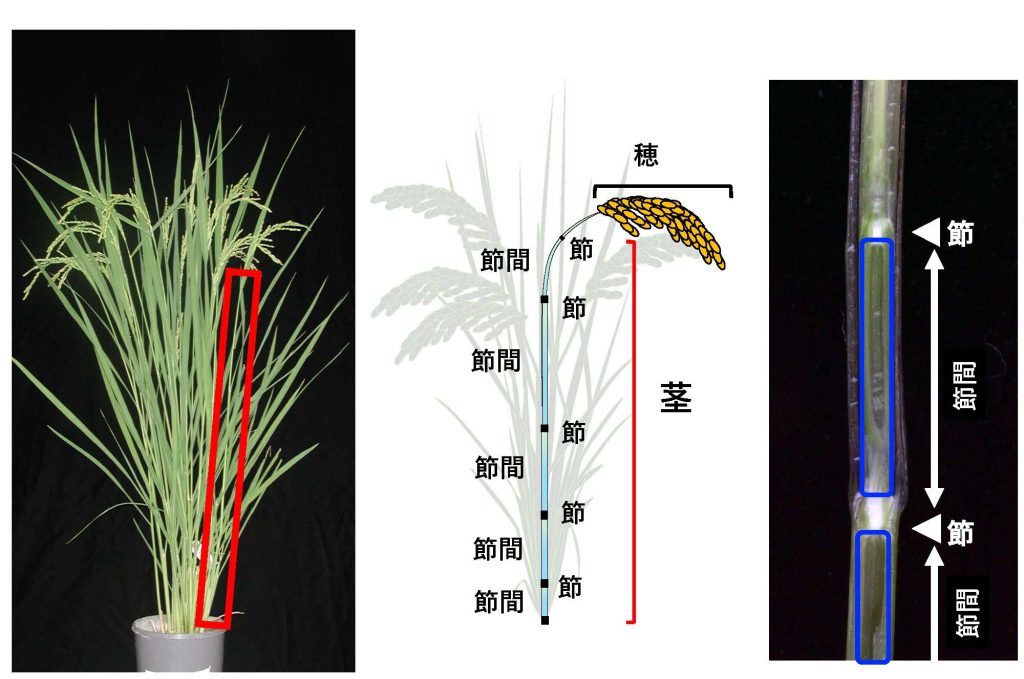
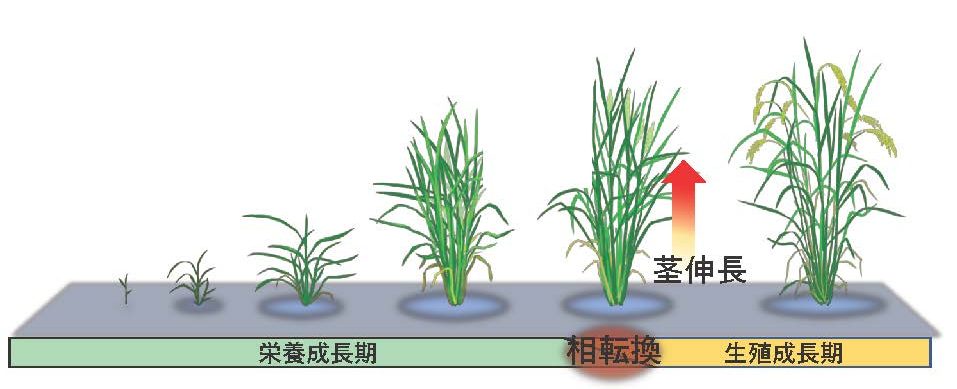
植物の茎は、節と節間から構成されています(図2)。単子葉植物のモデルであるイネ(イネ科植物)は節と節間の構造が明確で観察しやすいため、私たちの研究室では、茎伸長の研究材料として主にイネを用いています(節と節間構造が視覚的に明瞭でない植物も多いです)。植物の成長期間は大きく栄養成長期と生殖成長期に分けられます。イネの場合、栄養成長期には茎の伸長はほとんど見られませんが、生殖成長期に入ると茎の伸長が急速に始まります(図3)。
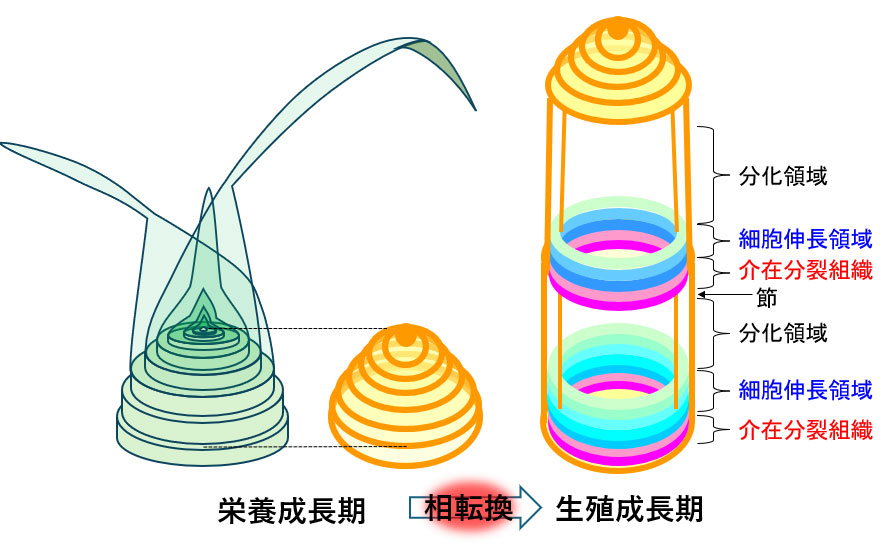
この茎の伸長は、節間の基部に位置する「介在分裂組織(intercalary meristem)」と呼ばれる、分裂能をもつ細胞群が活性化することで引き起こされます。介在分裂組織は、栄養成長期には分裂活性を示しませんが、生殖成長期に入ると急激に細胞分裂を開始し、その後、分裂した細胞が縦方向に伸長することで、節間が下から順に上方へと伸びていきます(図4)。
ジベレリン(GA)と茎の伸長
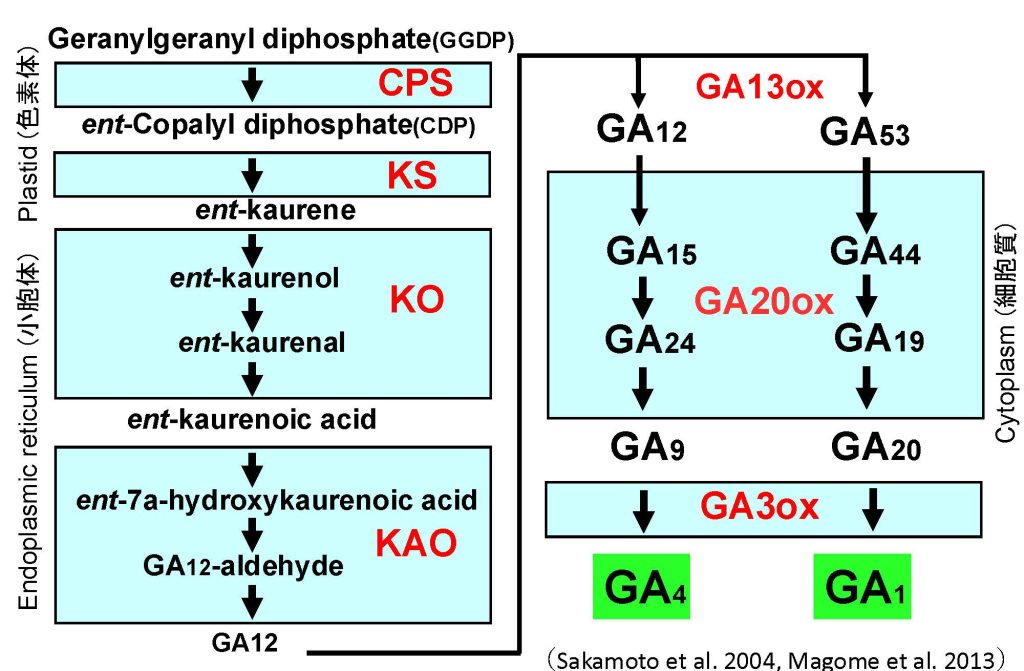
茎伸長には、ジベレリン(GA)という植物ホルモンが主に関わっています。GAはもともとイネを伸長させる物質として日本人によって発見され、その後日本人研究者とイギリスの研究者らによって化学構造が決定されました。植物において、GAが不足すると茎は短くなる一方で、GAが過剰に存在すると茎がより伸長します。先に述べたsd1遺伝子を持ったイネ半矮性品種や、Rht1遺伝子を持ったコムギ半矮性品種は、それぞれGAの生合成や細胞内情報伝達に関わる遺伝子に変異があり、これが茎の長さに影響を与えていることが判明しています。その後の研究により、イネやシロイヌナズナにおけるGAの生合成経路(図5)や細胞内情報伝達経路(図6)が明らかになり、茎の伸長メカニズムの理解が大きく進みました。
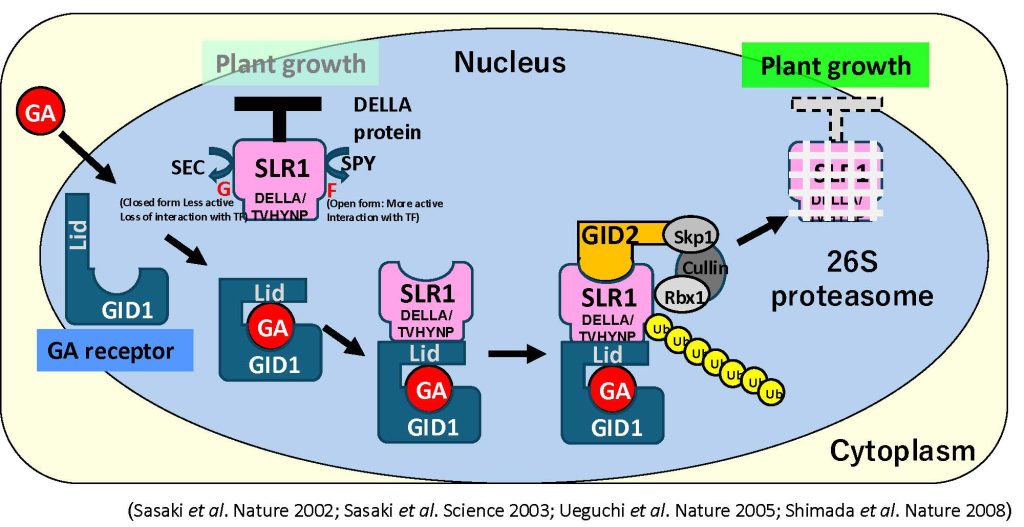
SLR1(DELLAタンパク質)は植物の成長を抑制する。GAが生産され核内受容体であるGID1に受容されると、GA-GIDはSLR1とコンプレックスを作り、その後、E3ライゲースでGID2がGA-GID-SLR1コンプレックスにリクルートされ、SLR1をユビキチン化する。ユビキチン化されたSLR1は26Sプロテアソームによって分解され、植物成長の脱抑制がおこる。
茎伸長の開始を決める分子スイッチの発見
ではGAがあればいつでもイネの茎は伸長するのでしょうか?実は、栄養成長期のイネに高濃度のGAを投与しても茎はほとんど伸長しません。しかし、生殖成長期のイネに高濃度のGAを投与すると細胞分裂と細胞伸長を開始し茎は著しく伸長します。この現象は、栄養成長期から生殖成長期への移行とともに、介在分裂組織の細胞がGAに反応できるようになることを示しており、この切り替えを担う「分子スイッチ」の存在が示唆されました。
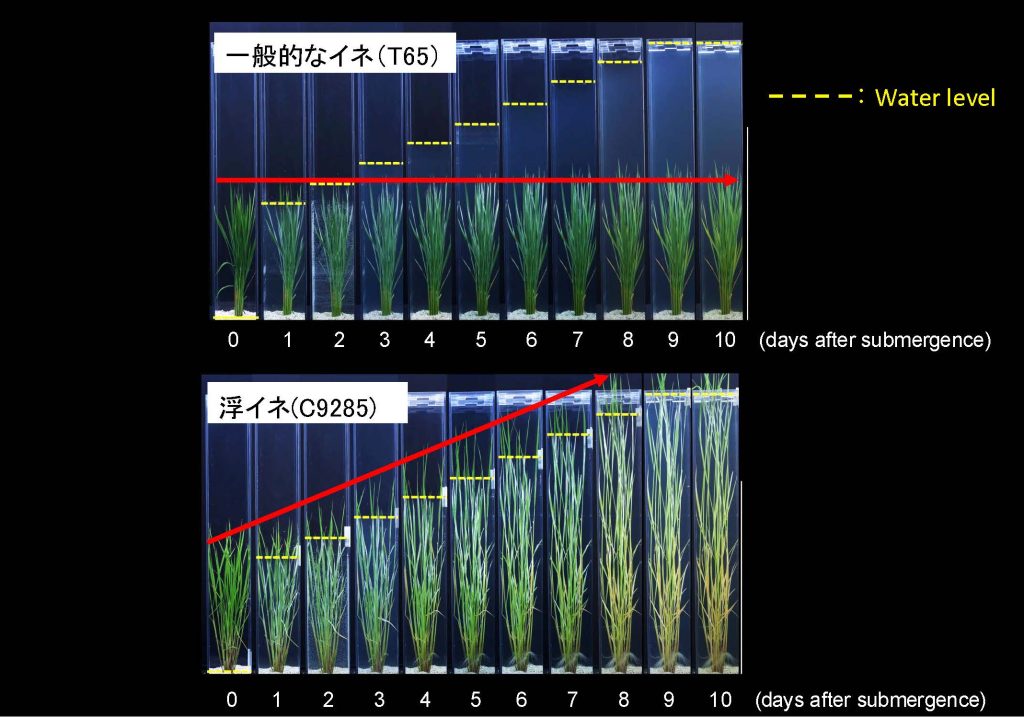
この分子スイッチの実体を解明するうえで、私たちは「浮イネ」と呼ばれる東南アジア在来のイネに注目しました。東南アジアでは雨季と乾季がはっきりと分かれ、雨季には長期の降雨があり、河川が氾濫して大洪水が起こります。この洪水は日本の洪水と異なり、ゆっくりゆっくり水位が上昇し、なかには数メートルにおよぶ水位が数ヶ月間にわたり継続する地域もあります。浮イネはこの洪水環境に適応した品種です。一般的なイネは冠水しても茎を伸長しませんが、浮イネは冠水することで急激な茎伸長を示します(図7)。
茎伸長の分子スイッチを研究する上で、浮イネは非常に重要なブレークスルーをもたらしました。一般的なイネは栄養成長期にGAを投与しても茎伸長は起こりませんが、何と浮イネは栄養成長期にGAを投与すると著しい茎伸長を誘導します。すなわち浮イネの茎では栄養成長期においても、すでにGA応答性の「分子スイッチ」がONになっており、介在分裂組織の細胞がGAに反応して細胞分裂できることを意味します。
分子スイッチの正体であるACE1とDEC1の発見
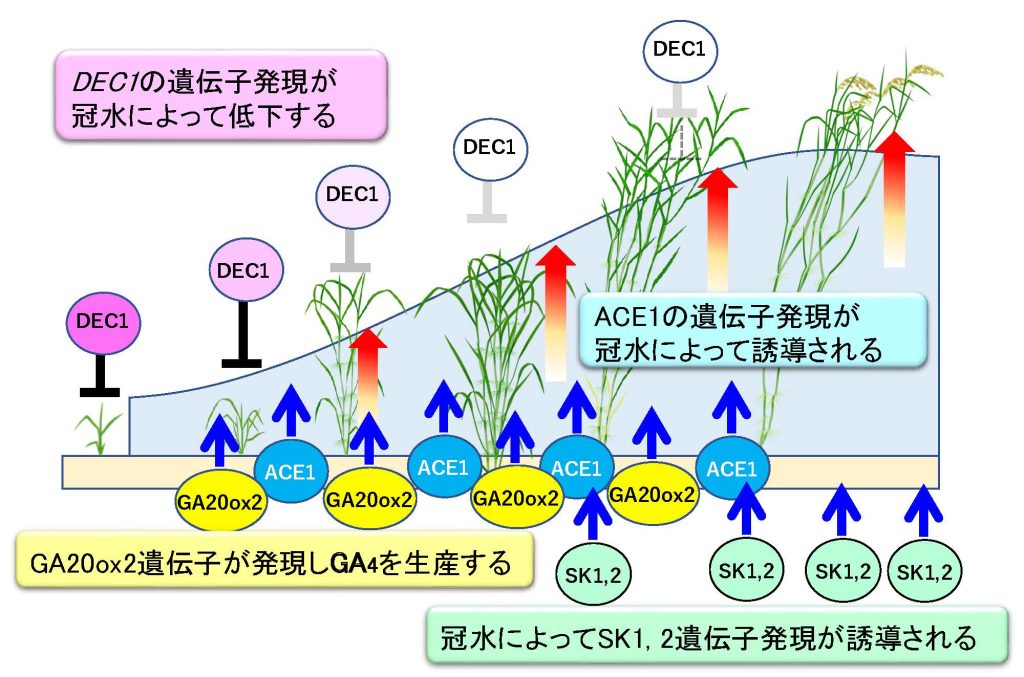
私たちは浮イネを用いた詳細な研究から、茎の伸長開始を制御する2つの新規遺伝子を発見し、それぞれACE1 (Accelerator of internode elongation 1)とDEC1 (Decelerator of internode elongation1)と命名しました。ACE1は機能未知のペプチドをコードしていますが、この遺伝子が発現していると節間の介在分裂組織においてGA依存的な細胞分裂と細胞伸長が誘導され、茎の伸長が開始されます。そのためACE1はGAに応答した節間伸長の「正の分子スイッチ」であると考えられました。さらに浮イネは栄養成長期からACE1を発現することで、早期の茎伸長を可能にしていることが明らかとなりました。一方、DEC1はC2H2モチーフを保持する転写因子をコードしており、介在分裂組織のGA応答性を抑制する働きを持ちます。すなわち、DEC1は茎伸長を抑制する「負の分子スイッチ」として機能していると考えられました。浮イネでは冠水依存的にDEC1の遺伝子発現が低下することで介在分裂組織の細胞がGA反応できるようになることで茎伸長を誘導していることが明らかとなりました。また浮イネでは冠水依存的にGA生合成酵素遺伝子の一つであるGA20ox2を発現させてGAを生産します。このように茎伸長の開始を制御する分子スチッチは少なくとも2つ存在し、アクセルとブレーキのようにアンタゴニスティック(拮抗的)に機能することで、介在分裂組織の活性が精緻に制御されています。さらに浮イネでは冠水に伴いGAの生合成が促進されるだけでなく、茎伸長を加速するAP2型転写因子をコードするSK1および SK2遺伝子も発現し、これら複数の経路が連携することで急激な茎伸長を起こしていることが分かってきました(Hattori et al. 2009, Kuroha et al. 2018, Nagai et al. 2020)(図8)。
それでは、一般的なイネではどのように茎伸長が制御されているのでしょうか?
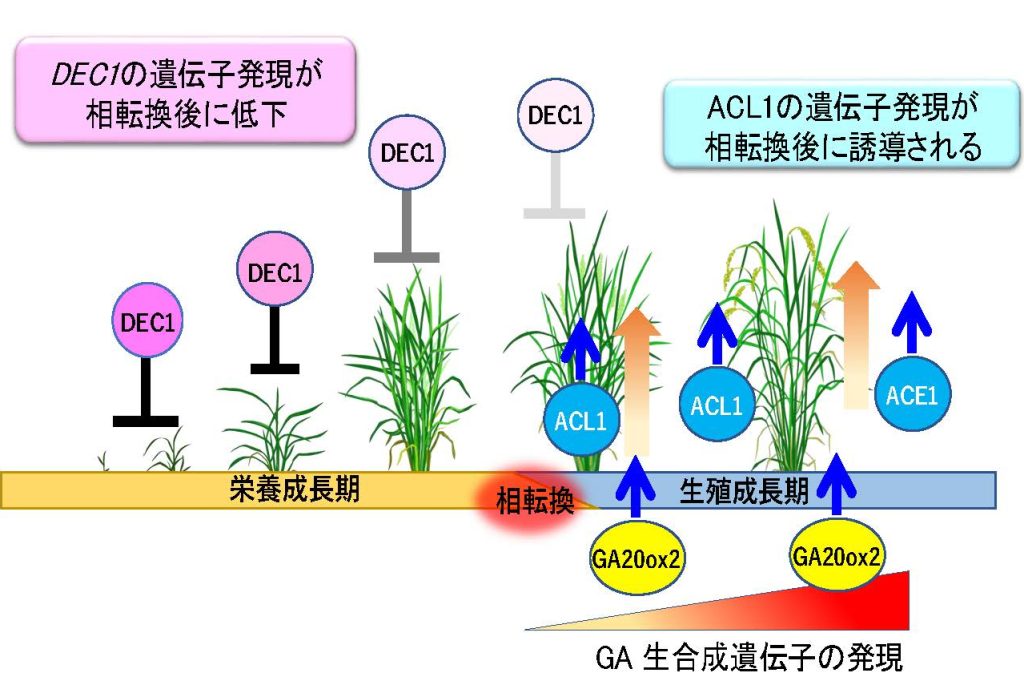
一般的な栽培イネである日本晴ではACE1遺伝子のコーディング領域に1bpの挿入があり遺伝子機能が欠損しています。しかし、イネのゲノム上にはACE1に配列が酷似したACL1 (ACE1-LIKE 1)が存在しており、生殖成長期への相転換後にこの遺伝子が発現することで介在分裂組織のGA応答性が高まり、節間の伸長が可能になることが明らかになりました。また日本晴においても浮イネと同様にDEC1遺伝子を保持していますが、日本晴では冠水環境下でもDCE1を高発現することで茎伸長が抑制されています。ところが、生殖成長期に移行すると日本晴においてもDEC1遺伝子の発現が減少し、介在分裂組織の細胞がGAに反応できるようになります。さらに、イネの生殖成長期にはGAの生合成が活性化されます。このように、一般的なイネにおいても、浮イネと同様にGAの生合成、分子スイッチの転換、そして介在分裂組織の活性化という一連のしくみによって茎の伸長が制御されていることがわかってきました(図9)。
ACE1とDEC1の選抜の歴史
イネの栽培化の過程におけるACE1とDEC1の選抜の歴史も明らかになっています。日本型の栽培イネは約1万年の歳月をかけ、イネの野生種の1つであるOryza rufipogon(オリザ ルフィポゴン)から人為選抜が繰り返されることで栽培化されました。Oryza rufipogonのACE1遺伝子配列を解読したところ浮イネと同様の機能型を保持していたことから、Oryza rufipogonは栄養成長期からの茎伸長が可能であると考えられます。一方、約600系統の日本型の栽培イネ(Oryza sativa. ssp. japonica)は全て非機能型のACE1を保持していました。すなわち、もともとイネはACE1を保持し栄養成長期にも茎伸長するタイプであったが、早期の茎伸長や過度の茎伸長は倒伏をもたらし、収量の低下につながることから、野生種から栽培種への栽培化の初期に人類が、倒伏しにくいイネが有利だったため変異型ace1型を選抜したのではないかと推測されています。
茎の伸長を抑制する遺伝子DEC1についても、進化の過程で自然環境に適応するための選抜の痕跡が確認されています。Oryza rufipogonの解析により、冠水環境などに適応した一部の系統では、DEC1の発現が低く抑えられ、茎がよく伸びるタイプ(浮イネ型DEC1)が選ばれてきたことが示されました。一方で、栽培イネの多くではDEC1の発現が高く、茎の伸長が抑制されるタイプ(日本晴型DEC1)が選抜されていました。このことから、DEC1の高発現型は、倒伏を防ぐための形質として農耕初期の人為選抜された可能性があり、栽培化においてACE1の機能喪失とともに、負のスイッチであるDEC1の発現調節も選抜の対象となっていたことが示唆されました。
このように、ACE1とDEC1という拮抗的に働く2つの遺伝子がイネの栽培化と環境適応の両面で重要な役割を果たしてきたと考えられます。
現在取り組んでいる研究
これまでの研究により、イネにおける茎伸長に関わるGA生合成酵素遺伝子、GAの細胞内情報伝達に関連する遺伝子、そしてACE1(ACL1)やDEC1といった新規の遺伝子が同定し、茎の伸長メカニズムの一端を明らかにすることができました。しかし、これらの遺伝子が「いつ」「どこで」「どのように」発現し、どのような遺伝子群を制御することで茎伸長が起こるのかという、遺伝子ネットワークの全体像については未解明です。現在、私たちの研究室では、遺伝学、発生学、分子生物学、生理学、生化学など、多様な分野の知識や技術を駆使しこの複雑なネットワークの解明を進めています。
また、イネで発見されたこれらの遺伝子が、他の維管束植物においても茎伸長を制御しているのかという疑問にも取り組んでいます。特に、単子葉植物と双子葉植物の茎伸長メカニズムの共通性と相違点が存在するのかを探るべく、現在、イネのみならず双子葉植物のモデルであるシロイヌナズナを用いて、ACE1やDEC1のホモログ遺伝子の機能解析を中心に研究を進めています。さらに、茎伸長を促進する植物ホルモンのGAについても、イネとシロイヌナズナで「いつ」「どこで」 GA生合成が行われているかという時空間的な制御機構を明らかにするため、現在、GAアトラスの作成にも取り組んでいます。これにより、茎伸長を促進するGAの生成パターンを可視化し、その制御機構の理解を深めようとしています。
また、コケ植物のゲノムにも、ACE1やDEC1に相同性のある遺伝子が見いだされています。これらの遺伝子はどのような機能を保持しているのか、さらに茎を持たないコケ植物における遺伝子機能の進化的意義に迫る研究を進めています。
さらに、シロイヌナズナやイネは栄養成長期から生殖成長期に変わる相転換のタイミングで茎伸長を開始します。すなわち、茎頂分裂組織が花芽へと分化するタイミングで茎伸長が起こります。この花芽分化と茎伸長の連動性の分子メカニズムついても全く明らかになっていません。そのため私たちは、この花芽分化と茎伸長のタイミングがどのように連動しているのかについても明らかにする研究に取り組んでいます。
基礎研究から応用研究へ~WISHプロジェクト~
私たちは、基礎研究から得られた成果をもとに、イネの品種改良を行い普及するWISHプロジェクト(WISH: Wonder rice Initiative for food Security and Health)を進めています。
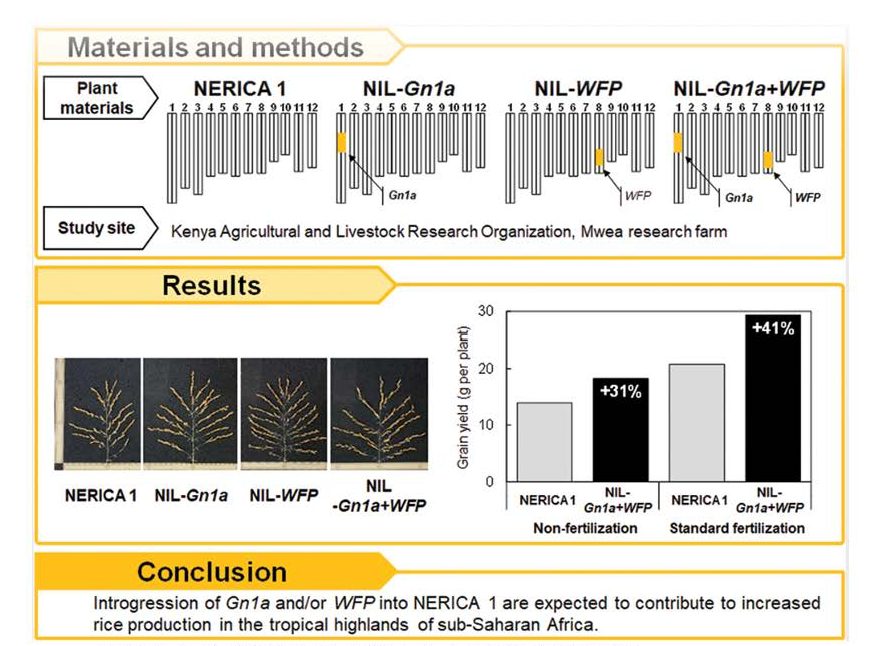
研究室ではこれまでイネの茎伸長に関わる遺伝子のだけでなく、イネの種子数を増加させる遺伝子(Gn1a)や穂の1次枝梗数を増加させる遺伝子(WFP)など、有用農業形質を司る遺伝子を多数見いだしてきました(Ashikari et al. 2005, Miura et al. 2010)。これらの遺伝子をマーカー選抜育種法(戻し交雑と分子マーカーによる選抜)を用いて、イネの改良を行っています。例えば、アフリカで作付けされているネリカ1という品種にGn1aやWFP遺伝子をそれぞれ導入した系統、または2つの遺伝子を同時に導入した系統は1穂粒数が増加しました。さらに、これらの系統はケニアの3地点で圃場試験が行われ、オリジナルのネリカ1より収量性が高い結果となりました(Kikuta et al. 2023, 図10)。現在、ケニアでこれらの系統を品種化と普及に向けた準備が進められています。また、これまでにベトナムのイネ品種の開発と普及にも取り組み(九州大学とベトナム国家農業大学との共同開発)、2品種(DCG66と DCG72)がベトナムの国家品種として認定されました。2024年時点で、DCG66は約2500ha、DCG72は約1000haで栽培されており、現在も栽培面積は拡大中です。さらにミャンマーのイネの品種改良にも取り組み、育成した系統群の品種登録を進めているところです。このように、研究室で得られた成果を社会実装することにもチャレンジしています。